COMUNICATO
Rinnovo dell’autorizzazione all’immissione in commercio dei medicinali omeopatici per uso umano «Vanda 1, Vanda 50 e Vanda 47». (19A00068) (GU Serie Generale n.8 del 10-01-2019)
Estratto determina AAM/AIC n. 181/2018 del 17 dicembre 2018
1. E' rinnovata l'autorizzazione all'immissione in commercio per
i seguenti medicinali omeopatici descritti in dettaglio nell'allegata
tabella, composta da pagina 1, che costituisce parte integrante della
presente determina, alle condizioni e con le specificazioni ivi
indicate:
VANDA 1, VANDA 50, VANDA 47.
2. Il titolare dell'autorizzazione all'immissione in commercio e'
Vanda Omeopatici S.r.l. con sede legale e domicilio fiscale in via
Solferino 10, 00044, Frascati (RM).
Stampati
1. Le confezioni dei medicinali di cui all'art. 1 della presente
determina devono essere poste in commercio con le etichette e, ove
richiesto, con il foglio illustrativo, conformi ai testi allegati
alla presente determina e che costituiscono parte integrante della
stessa.
2. Resta fermo l'obbligo in capo al titolare del rinnovo
dell'autorizzazione all'immissione in commercio di integrare le
etichette e il foglio illustrativo con le sole informazioni relative
alla descrizione delle confezioni ed ai numeri di A.I.C. dei
medicinali omeopatici oggetto di rinnovo con la presente determina.
3. In ottemperanza all'art. 80, commi 1 e 3, del decreto
legislativo 24 aprile 2006, n. 219, e successive modificazioni le
indicazioni di cui agli articoli 73, 77 e 79 del medesimo decreto
legislativo devono essere redatte in lingua italiana e, limitatamente
ai medicinali in commercio nella Provincia di Bolzano, anche in
lingua tedesca. Il titolare del rinnovo dell'autorizzazione
all'immissione in commercio che intende avvalersi dell'uso
complementare di lingue estere, deve darne preventiva comunicazione
all'AIFA e tenere a disposizione la traduzione giurata dei testi in
lingua estera.
4. In caso di inosservanza delle predette disposizioni si
applicano le sanzioni di cui all'art. 82 del suddetto decreto
legislativo.
Smaltimento delle scorte
I lotti dei medicinali di cui all'art. 1, gia' prodotti
antecedentemente alla data di entrata in vigore della presente
determina, possono essere mantenuti in commercio fino alla data di
scadenza indicata in etichetta.
Misure di farmacovigilanza
1. Per i medicinali omeopatici non e' richiesta la presentazione
dei rapporti periodici di aggiornamento sulla sicurezza (PSUR).
2. II titolare del rinnovo dell'autorizzazione all'immissione in
commercio e' tenuto comunque a valutare regolarmente la sicurezza dei
medicinali omeopatici e segnalare eventuali nuove informazioni che
possano influire su tale profilo.
Decorrenza di efficacia della determina: dal giorno successivo a
quello della sua pubblicazione, per estratto, nella Gazzetta
Ufficiale della Repubblica italiana.
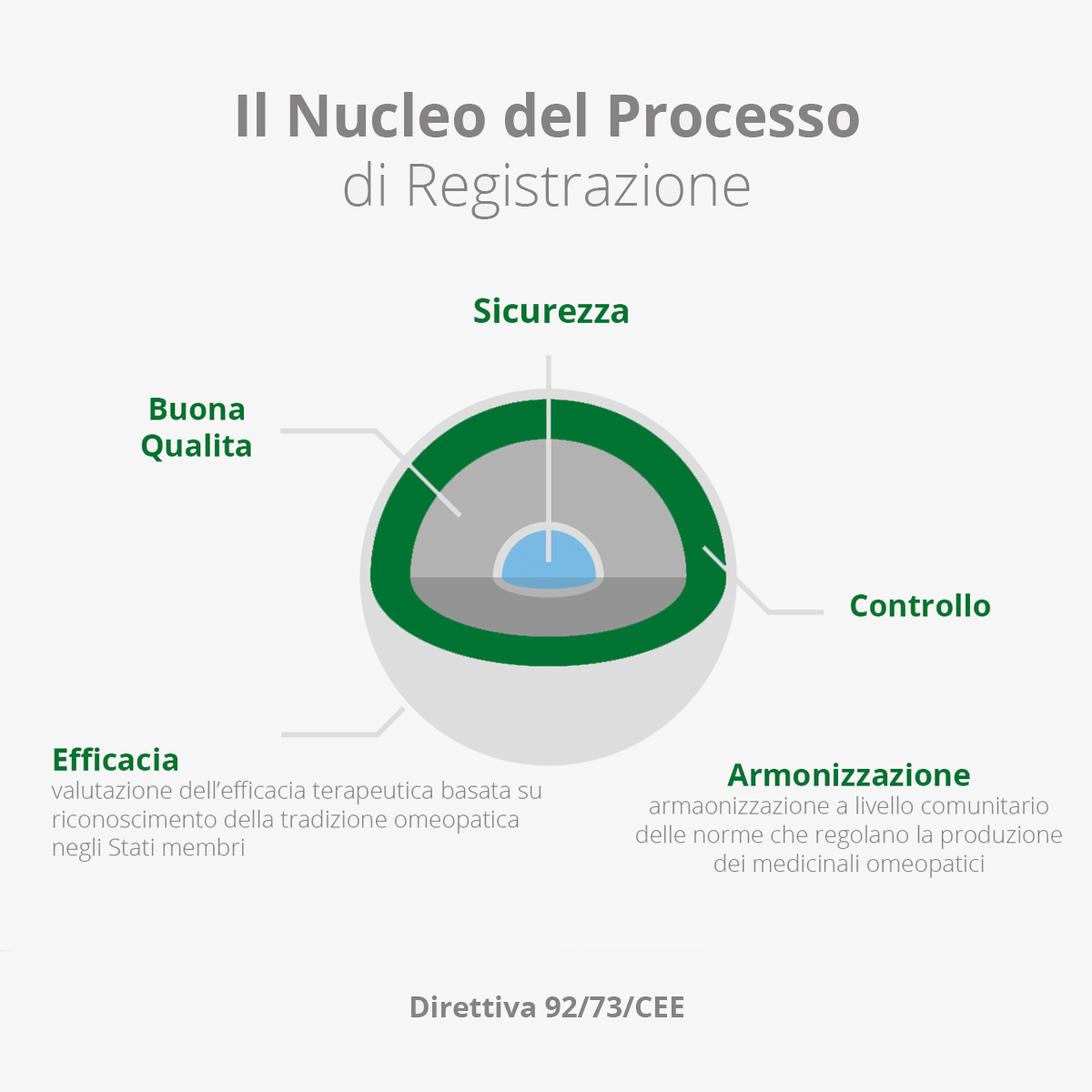
Cosa sono le aic dei Medicinali Omeopatici? Qual’è il nucleo del processo di registrazione? Leggi l’approfondimento
Con le direttive 65/65/CEE e 75/319/CEE, il legislatore europeo fissò le prime disposizioni legislative, regolamentari e amministrative riguardo i medicinali.
Il campo di applicazione venne esteso ed ampliato agli omeopatici con l’emanazione della direttiva 92/73/CEE.
Questa direttiva sottolineò come, pur non essendo ufficialmente riconosciuti, gli omeopatici venivano prescritti e utilizzati in tutti gli Stati membri e, da questo momento, venne loro riconosciuto lo status di medicinali.
Con la conseguente esigenza di dover ottenere, anche per questi prodotti, una autorizzazione all’immissione in commercio (AIC). Continua la lettura …